Ácido, segundo Arrhenius (1887), é toda substância que, em solução aquosa, libera única e exclusivamente íons H+. Um exemplo é o ácido clorídrico , de fórmula HCl:
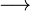 H+ + Cl –
H+ + Cl –Muitos anos mais tarde, em 1923, Brønsted e Lowry propuseram a idéia de que ácido é uma substância que pode ceder prótons (íons H+).
Esta última definição, generaliza a teoria de ácidos de Arrhenius. A teoria de Brønsted e Lowry de ácidos também serve para dissoluções não aquosas; as duas teorias são muito parecidas na definição de ácido, mas a de Brønsted-Lowry é muito mais geral.
Lewis em 1923 ampliou ainda mais a definição de ácidos, teoria que não obteve repercussão até alguns anos mais tarde. Segundo a teoria de Lewis um ácido é aquela espécie química que, em qualquer meio, pode aceitar um par de elétrons. Desta forma incluem-se substâncias que se comportam como ácidos, mas não cumprem a definição de Brønsted e Lowry, sendo denominadas ácidos de Lewis. Visto que o próton, segundo esta definição, é um ácido de Lewis (tem vazio o orbital 1s, onde pode alojar-se o par de elétrons), pode-se afirmar que todos os ácidos de Brønsted-Lowry são ácidos de Lewis, e todos os ácidos de Arrhenius são de Brønsted-Lowry.
- Exemplos de ácidos de Brønsted e Lowry: HCl, HNO3, H3PO4 – se doarem o H+ durante a reação.
- Se estiverem em solução aquosa também são ácidos de Arrhenius.
- Exemplos de ácidos de Lewis: Ag+, AlCl3, CO2, SO3 – se receberem par de elétrons.
Muito Legal esse Blog , espero que esteja sempre atualizado porque sempre vou visitar para vr as novidades e tudo mais , Ótimo !
ResponderExcluirAqui sempre te manteremos informado sobre as informações, fórmulas , news etc.
ResponderExcluirVolte sempre!